Oxidationsgrade von Arsen: chemische Eigenschaften von Arsen
Bevor man den Oxidationszustand betrachtetArsen, wir werden seine Position im Periodensystem und die Merkmale der Struktur offenbaren. Darüber hinaus nennen wir die grundlegenden physikalischen und chemischen Eigenschaften dieses chemischen Elements.

Position in der PS
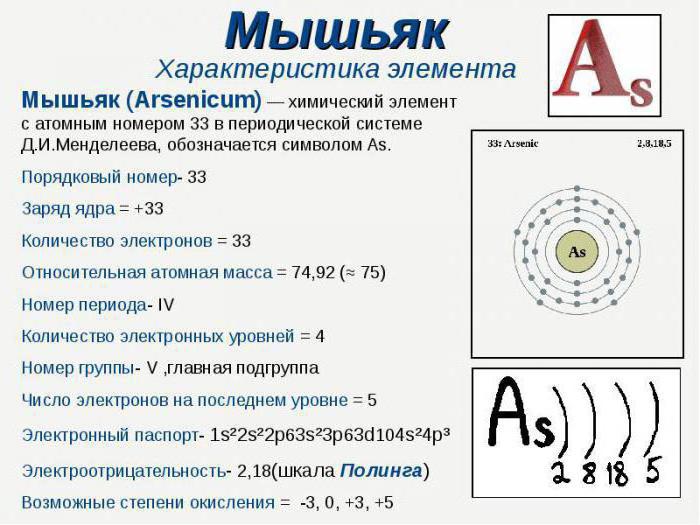
Die wichtigsten Oxidationsstufen von Arsen, chemischEigenschaften, Anwendung - all dies kann gelernt werden, indem man den Ort des Elements im Periodensystem von Mendelejew betrachtet. Arsen befindet sich in der fünften Gruppe, der Hauptuntergruppe, ist ein Mitglied der Stickstofffamilie. Es hat eine relative Atommasse von 74,9216. Die Hauptoxidationsgrade von Arsen sind genau auf die Gruppe bezogen, in der es sich in der SS befindet. Dieses Element hat 33 Seriennummer. Die Anzahl der Energieniveaus entspricht der Nummer des Zeitraums, in dem das Element liegt, es ist gleich vier.
Betrachten Sie die Anordnung von Elektronen auf jedemAtomhülle. Auf der ersten Energieniveau gibt es nur zwei gekoppelte Elektronen, die zweite Schale ist durch acht Teilchen besetzt: 2s und 6p. Auf der dritten Ebene, abgesehen von ihnen, gibt es zehn d-Elektronen, also nur 18 Teilchen. Das externe Energieniveau ist ein 2s-Elektron, sowie drei ungepaarte p-Elektronen. Die Anzahl der Valenzelektronen bestimmt die möglichen Oxidationsgrade von Arsen.

Seiten der Geschichte
Es wird Arsen den fünf "Alchemisten" zugeschriebenElemente aus dem Mittelalter bekannt. Ein interessanter Punkt ist die Tatsache, dass vier von ihnen in der fünften PS-Gruppe sind. Damals wusste niemand den Grad der Oxidation von Arsen zu bestimmen, aber seine Verbindungen wurden erfolgreich zur Herstellung von Medikamenten und zur Herstellung von Farben verwendet.
Nach dem Ersatz der Steinzeit durch die Bronzezeit, Menschenlernte, wie man diese Legierung mit besonderen Eigenschaften herstellt. Es stellte sich heraus, dass es bis zu 7 Prozent Arsen und nur 3 Prozent Zinn enthielt. Wissenschaftler glauben, dass bei der ersten Schmelze von Bronze anstelle von Malachit, die grün ist, fälschlicherweise die grünen Sulfide von Kupfer-Arsen-Mineralien genommen.
Die erstaunliche Leistung der resultierenden Legierung machte es bei alten Meistern beliebt. Sie suchten gezielt in der Natur nach Mineralien, die die Substanz enthalten.
Oxidationsgrade von Arsen in Verbindungen von solchenTyp positiv, entspricht seiner höheren Wertigkeit. Um arsenhaltige Sulfide zu identifizieren, wird das Mineral erhitzt. Das Auftreten eines spezifischen Knoblauchgeruchs ist eine Bestätigung für das Vorhandensein von Arsen in der Verbindung. Allmählich von der Verhüttung von Arsen-Bronze abgelehnt. Unter den Gründen für die Einstellung der Produktion nennen Wissenschaftler die ständige Vergiftung der Meister während der Arbeit.

Natürliche Mineralien
In Form eines Minerals die Substanz, die wir in Betracht ziehenseit der Antike bekannt. Zum Beispiel erscheint der Oxidationszustand von 3 Arsen in einer Verbindung, die im alten China als "Minenstaub" bekannt ist. Aristoteles beschrieb das Mineral Sandarak, das ein Arsensulfid ist. Übersetzt aus der lateinischen Sprache, klingt sein Name wie "goldene Farbe". Benutzte es in diesen fernen Zeiten als gelber Farbstoff.
Im elften Jahrhundert, Alchemistenverschiedene Arten dieser Substanz. Die Oxidationsgrade von Arsen in den durch diese Spezies dargestellten Verbindungen entsprechen der Gruppennummer. Weißes Arsen nannte es sechswertiges Oxid, Gelb hieß Sulfid und Rot - As4S4 (Tetrasulfidtetrasyyaka).
Die weiße Variante wurde durch Sublimation von Verunreinigungen in erhaltender Prozess der Verbrennung von Kupfererzen, die Arsen enthalten. Als Kondensat aus dem gasförmigen Zustand fällt Arsenoxid als weißer Niederschlag aus. Es wurde seit der Antike als Mittel zur Schädlingsbekämpfung eingesetzt.
Im dreizehnten Jahrhundert, Albert der Großeeine Metallsubstanz wird erhalten. Er erhitzte das gelbe Arsen mit Seife. Die durch die Wechselwirkung erhaltene Substanz bestätigte nicht die "mystische Verbindung" der sieben Metalle mit den Planeten. Gerade wegen des offenbarten Widerspruchs der alten Alchemisten wurde Arsen als "illegitimes" Element betrachtet. Es war in jenen fernen Zeiten, dass seine Fähigkeit, Kupfer eine weiße Farbe zu geben, wegen der er ein Mittel genannt wurde, "bleichende Venus", wurde offenbart.
Als einzelne Substanz diesdas chemische Element wurde erst in der Mitte des 17. Jahrhunderts identifiziert. Der deutsche Apotheker Johann Schröder gelang es, ihn durch chemische Reduktion von Kohlenoxiden zu isolieren. Nach einiger Zeit gelang es Nichola Lemery, das Metall durch Erhitzen von Kali, Seife, Arsenoxid zu extrahieren. Im 18. Jahrhundert wurde dieses Metall als ungewöhnliches "Halbmetall" bezeichnet.
Am Ende des 18. Jahrhunderts wurde der schwedische Chemiker K.V. Scheele erhielt Arsensäure, in der der höchste Grad der Oxidation von Arsen auftritt: +5. Im 19. Jahrhundert wurden organische Substanzen identifiziert, die Arsen enthalten.

In der Natur sein
Der höchste und niedrigste Oxidationsgrad von Arsenmanifestieren sich in seinen natürlichen Verbindungen. In der Erdkruste beträgt die prozentuale Konzentration dieses Elements nicht mehr als 5 Gramm pro Tonne. In vielen Mineralien ist es gleichzeitig mit Nickel, Kobalt, Kupfer, Eisen enthalten.
Gegenwärtig ungefähr zweihundertverschiedene natürliche Mineralien, zu denen auch das chemische Element gehört, das wir in Betracht ziehen. In Anbetracht, dass sie den höchsten und den niedrigsten Grad der Oxidation des Arsens manifestieren, haben sie unterschiedliche Anwendung. Zum Beispiel weist Arsen in Kombination mit Antimon einen negativen Oxidationszustand auf. In Anbetracht die Tatsache, dass dieses Metall niedrige Elektronegativität ist, ein niedrigerer Oxidationsgrad von Arsen -3. Dieser Indikator ist charakteristisch für Arsenide sowie für das Mineral Almontit.
Die meisten Verbindungen mit Arsenmetallen sind unter Berücksichtigung der spezifischen Zusammensetzung intermetallische Verbindungen, die durch die variable Zusammensetzung dieses chemischen Elements gekennzeichnet sind.
Eigenschaften von Arseniden
Die Arsenide sind durch den Gehalt mehrerer charakterisiertMetalle mit einer ähnlichen Struktur von Kristallgittern. Diese Mineralien zeichnen sich durch metallischen Glanz aus, sie sind opak, haben eine leichte Härte.
Als Beispiele für natürliche Arsenide können die folgenden Verbindungen in Betracht gezogen werden:
- Lellingit, ähnlich wie Pyrit;
- Nickel, Nickelrotpyrit;
- Langisit;
- Oreonit;
- sperrylit.
Dies ist natürlich keine vollständige Listeähnliche Mineralien - derzeit gibt es etwa fünfundzwanzig solcher Verbindungen. Zu den häufigsten in der Natur gehören Arsenopyrit, genannt Arsenpyrit. Es ist ein Produkt, das durch Ersetzen der Schwefelatome in Pyrit durch Arsen erhalten wird. Verbindungen dieser Art, in denen der höchste Grad der Oxidation von Arsen nicht manifestiert ist, nennt man Sulfosalze.
Ihre Analoga betrachten Kobaltglanz,Gersdorfit, Enargit und auch Proustit. Letzteres ist ein wichtiges Silbererz, das sich in der oberen Schicht der wertvollen Adern befindet. Die Zusammensetzung von Sulfosalzen kann Edelmetalle der Platingruppe einschließen. Unter ihnen ist das Interesse von Irarsite, sowie von orsit vertreten. In ihrer Zusammensetzung werden seltene Metalle als ausgezeichnete Katalysatoren in organischen und anorganischen Synthesen verwendet.
Der maximale Grad der Oxidation von Arsenmanifestiert sich in seinen natürlichen Sulfiden. Zum Beispiel im orange-gelben Dimorphit, das Arsensulfid (5) ist. In den dreißiger Jahren des letzten Jahrhunderts, natürlichen Vorkommen von orpiment, auch in seiner Mitgliedschaft Sulfid, dreiwertigen Arsen, im Süden des Werchojansker Gebirge gefunden. Die Größe der erkannten Kristalle erreichte 60 Zentimeter Länge und das Gewicht wurde auf 30 Kilogramm geschätzt.

Eigenschaften von Arsenaten
Mögliche Grade der Oxidation von Arsen können seinBetrachten Sie das Beispiel der Salze. So zeigen Arsensäureverbindungen, genannt Arsenate, den maximalen Wert für dieses Metall: +5. Als Beispiel für solche Verbindungen geben wir Erythrin, das eine hellrosa Farbe hat. Dieses Salz wird Kobaltfarbe genannt, es hat die Formel Co3 (AsO4) 2 * 8H2O. Es ist auch möglich, das Gasrolit der bräunlich-roten Nuance in der Form (Ce, La, Nd) ArO zu bemerken4.
Im Zentrum von Schweden, der LangbanaFerromanganteilchen Karriere, wo es gefunden wurde und charakterisiert etwa fünfzig verschiedene Arsenate. Diese Verbindungen werden gebildet durch arsenige Säure mit Manganhydroxid reagieren, (2) bei niedrigeren Temperaturen.
Was sind die Oxidationsstufen in Arsenaten?Arsen? Die Eigenschaften dieser Salze bestätigen die Anwesenheit von Schwefel in ihnen. Trotz des Fehlens industrieller Anwendungen ermöglicht ihre ästhetische Erscheinung die Herstellung mineralogischer Sammlungen.
Eine interessante Geschichte ist Kupfernikel, dieentspricht dem Nickelmineral. Mittelalterliche deutsche Bergleute genannt Nickel auf den Berg des bösen Geistes, und „fake Kupfer“ genannt „kupfernikelem“. Meister wurde Ähnlichkeit kupferrotes Kristalle des Mineral Kupfererze enthüllt. Verwendet sie in Glas ein Produkt zu erhalten ist grün erhalten. Erst in dem Mineralogen Mitte des achtzehnten Jahrhunderts Axel Fredrik Cronstedt gelang aus dem Mineral Nickel zu isolieren.
Besonderheiten der Unterkunft in der Natur
Arsen zeichnet sich durch hohe Trägheit aus,So kann es in einem nativen Zustand gefunden werden. Ein ähnliches Metall in der Zusammensetzung weist zwei bis sechzehn Prozent Verunreinigungen auf, hauptsächlich werden sie Silber, Eisen, Kobalt, Nickel sein. In unserem Land haben Geologen in der Region Amur, Transbaikalien, ursprüngliches Arsen entdeckt.
Es kann in Felsen, in Mineralien und in Pflanzen gefunden werden, daher wird es zu Recht oft als das allgegenwärtige Element bezeichnet.
Was ist der maximale und minimale GradOxidation von Arsen? Der höchste Wert entspricht der Nummer der Gruppe, in der sich dieses Element befindet, und ist +5. Dies ist typisch für Verbindungen, in denen es reduzierende Eigenschaften aufweist. Weitere Details der Verbindung dieses einzigartigen Metalls werden später betrachtet.
Auf dem Globus ist Arsen extrem ungleich verteilt. Der Grund liegt in der Bildung der Lithosphäre sowie in den Desorptions- und Sorptionsprozessen in Sedimentgesteinen und Böden.
Aufgrund der ausgezeichneten Löslichkeit dieses Metalls in Wasser wandert es leicht. Zum Beispiel wird es in einem feuchten Klima aus dem Boden ausgewaschen, gefolgt von einer Bewegung mit Grundwasser und Flüssen.
Physiologische Wirkung
In erheblichen Mengen ist Arsen enthalten inMineralwasser. Es gibt bestimmte Standards für den Gehalt dieses Metalls. Wenn die zulässigen Werte überschritten werden, entsteht eine ernsthafte Bedrohung für den menschlichen Körper. Im Laufe von chemischen Studien wurde festgestellt, dass Arsen in verschiedenen Formen in natürlichem Wasser enthalten sein kann. Was sollten die Oxidationsstufen von Arsen sein? Die Eigenschaften der in Wasser gefundenen Verbindungen bestätigen die Anwesenheit des Metalls als arsenige Säurelösung.
Arsen in Lebendform enthält etwa 6 mg pro 1kg. Ein Teil der Meeresalgen kann die oben genannte Substanz in einem solchen Ausmaß ansammeln, dass sie für den menschlichen Körper gefährlich sein kann. Einige ihrer in asiatischen Ländern vorkommenden Arten können sich in einer reinen Säurelösung vermehren. Sie werden als Mittel zur Rattenbekämpfung verwendet. Im menschlichen Hirngewebe sowie in seinen Muskeln ist eine ausreichende Menge dieses Metalls vorhanden. Darüber hinaus ist es in den Nagelplatten vorhanden, sammelt sich in den Haaren.
Physische Eigenschaften
Trotz der Tatsache, dass Arsen aussiehtMetall, es hat auch nicht-metallische Eigenschaften. Zum Beispiel ist es nicht möglich, Salze mit Schwefelsäure zu bilden, die als säurebildendes Element wirken. Arsen kann in verschiedenen allotropen Modifikationen vorkommen, die an Phosphor erinnern. Am stabilsten ist graues Arsen, das beim Erhitzen wie Jod sublimiert.
Entsprechend der elektrischen Leitfähigkeit, diese Modifikationergibt zu Kupfer, überschreitet aber Quecksilber. Wenn man Arsendampf abkühlt, erhält man eine weiche, transparente Substanz mit einem gelben Farbton, ähnlich dem gelben Phosphor. Während des Erhitzens wandelt es sich in eine andere allotrope Modifikation dieses chemischen Elements um.
Beim Ausfallen von Arsendämpfen auf Glas kann man das Aussehen eines Spiegelfilms beobachten.
Arsenverbindungen
Der Grad der Oxidation von Arsen im höheren Oxidist +5, das entspricht seiner höheren Wertigkeit. Aber während der Sublimation der Dämpfe dieses Metalls in feuchter Luft bildet sich ein schwarzer Film seines Arsen-Anhydrids As2O.3. In dieser Form existiert im Grunde das Oxid dieses Elements. Dieses Oxid zeigt amphotere chemische Eigenschaften.
Bei der Oxidation wird es zu einem höheren Oxid, wobei Arsen den Wert der Oxidationsstufe +5 zeigt.
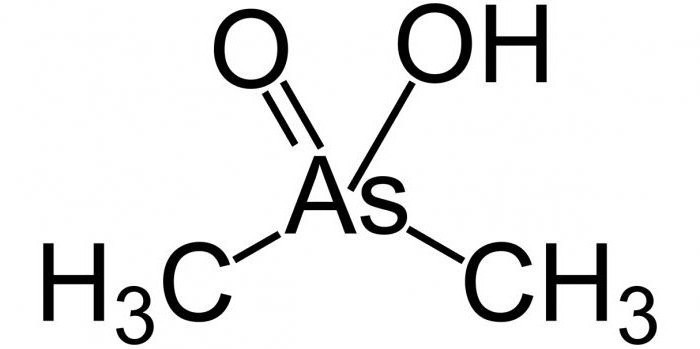
Reines Metall wird mit verdünnter Salpetersäure zu Blausäure H oxidiert3Aso3in der es eine Wertigkeit von 3 hat. Entsprechend seiner chemischen Fähigkeiten wird es als Säure mittlerer Stärke angesehen, ähnlich wie Borsäure. Salze sind Arsenit und zeigen hell reduzierende Eigenschaften.
In Chlorid hat das Metall eine Oxidationsstufe von +3,wirkt als typisches Metallelement. Salzartige Arsenide, die durch Wechselwirkung mit aktiven Metallen gebildet werden, unterliegen einer wässrigen Hydrolyse. Zum Beispiel Arsin (AsH3) ist ein giftiges, farbloses, geruchloses Gas.
Organometallverbindungen
Arsen kann verschiedene bildenORGANOMETALLISCHE VERBINDUNGEN. Zum Beispiel wurde am Ende des 18. Jahrhunderts, als mit Arsenoxid (3) Kaliumacetat destilliert wurde, eine rauchende Flüssigkeit mit einem unangenehmen Geruch erhalten. Das resultierende Produkt wurde als Alarsin bezeichnet. In nachfolgenden Studien wurde festgestellt, dass Arsen in seiner Zusammensetzung vorhanden ist.
Am Ende des neunzehnten Jahrhunderts wurden synthetisiertaromatische Arsine. Die Reaktion wurde unter Einwirkung einer Mischung von Arsentrichlorid und Arylhalogenid mit metallischem Natrium durchgeführt. Einige dieser Produkte zeigten antimikrobielle Eigenschaften. Heute werden Zehntausende Organo-Arsen-Verbindungen synthetisiert.
Verwendung von Arsen
Mehr als die Hälfte aller abgebauten Metallein Form verschiedener Verbindungen verwendet. In seiner reinen Form wird es praktisch nicht verwendet. In einer geringen Menge wird es in die Lagerlegierungen eingebracht. Solche Zusätze wirken sich positiv auf die Härte des fertigen Produktes aus und sind daher bei der Herstellung von elektrischen Kabeln und Batterien gefragt.
Mindestdosen von Arsen erhöhenKorrosionsbeständigkeit, verbessern die thermische Leistung von Messing und Kupfer. Wenn dieses Element keine zusätzlichen Verunreinigungen enthält, ist es in diesem Fall bei der Herstellung von Halbleitervorrichtungen gefragt. Um sie zu erzeugen, wird Arsen mit Germanium oder Silizium verschmolzen.
Darüber hinaus ist es eine hervorragende LegierungZusatz bei der Herstellung von Stahl. Als wertvolle Düse wird Arsen auch in der Nichteisenmetallurgie benötigt. Selbst mit seinem geringen Gehalt an der Legierung ist es möglich, die Festigkeit des hergestellten Produkts signifikant zu erhöhen. Arsen erhöht den Kupferfluss während des Gießens, was den Prozess der Drahtgewinnung erleichtert.
Es gibt einen gewissen negativen Effekt dieses Übergangsmetalls auf die Produktion. Seine Anwesenheit im Erz macht den Prozess zu einer schädlichen Produktion.
Unter den verschiedenen Arsenverbindungen von Interesserepräsentiert sein dreiwertiges Oxid. Es wird derzeit in Glasschmelzen verwendet. Salze mit einem Indikator von +5 sind als Antiseptika gefragt. Dieses Übergangselement ist eines der beliebtesten in der modernen chemischen Produktion, da es abhängig von der Prozessumgebung zwei Eigenschaften aufweist.